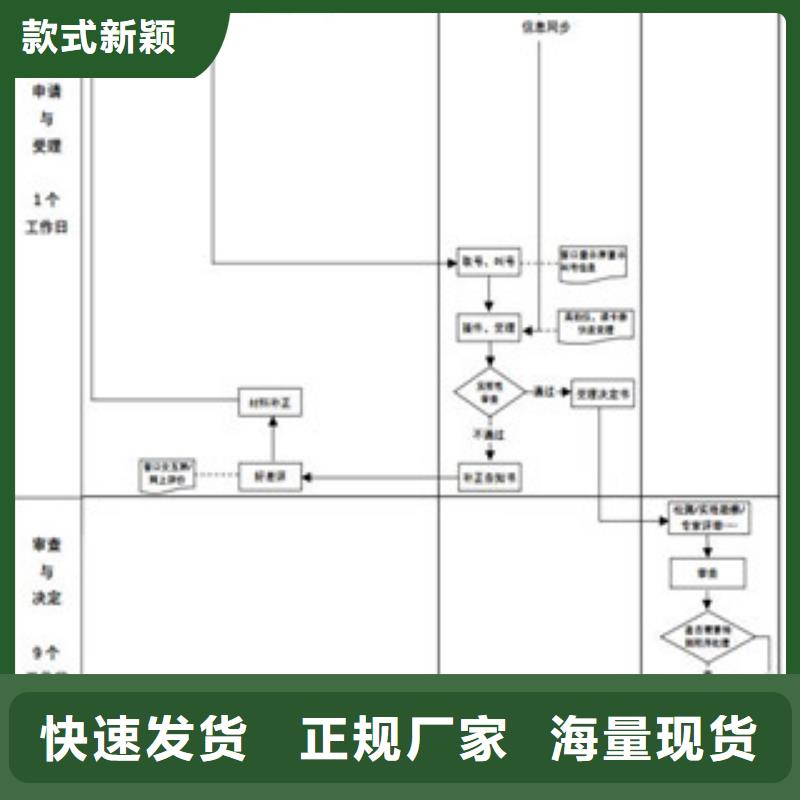
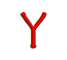68. 現場發現存在過期技術標準。
答:①查是由于有合理規定但執行出現問題,還是規定不合理,或是查新路徑有問題,或是沒有規定,開不符合項。②如果實驗室現場提出變更要求,如評審組具備能力,則進行確認,否則不予確認,要求實驗室向CNAS提交變更申請。
69. 實驗室提出的申請能力范圍內含“外資企業”的企業標準,如何確認?是否加注限定范圍后確認?
答:企業標準按非標方法要求予以確認。
70. 申請的項目,現場核查時沒有相應的對照品(標準溶液、標準菌種、標準氣)。
答:現場評審時,沒有標準物質或試劑等情況,不予認可。
71. 現場試驗安排有比例要求嗎?擴項的現場試驗比例要比維持認可的多嗎?
答:現場試驗沒有比例要求,但WI14-01作業指導書中規定了選擇現場試驗的要求。現場試驗應覆蓋所有關鍵檢測技術。
72. 現場發現實驗人員操作或從記錄上反映未按技術標準的規定操作。
答:①如屬對方法掌握不正確,則不該項目。②如屬依據經驗對方法的偏離,開不符合項,要求實驗室核查文件規定并必要的手續,制定內部作業指導書。
73. 對新申請擴項的產品標準,現場試驗安排:每個產品都要安排現場試驗見證還是同類產品(主要檢測參數相同)安排一種?
答:主要參數相同的同類產品,可以選擇難度系數 的產品做實驗,用難度大的覆蓋難度小的,同時必須關注不同產品之間,相同參數操作的差異和特殊參數的能力是否具備。
74. 已獲認可的標準中,如ASTMF963-11中引用的ASTM D3421:1975已作廢,上述兩個標準能否維持認可?
答:可以維持認可,但認可作廢標準時,應在“說明”欄注明理由。
75. 一些實驗室整改工作不到位,體現在:①盡管不符合項報告已明確,但實驗室理解不足,造成整改不到位;②整改就是糾正,無措施;是否在進行整改后一段時間內未再發現同類問題,也無法體現跟蹤驗證;③整改就是補記錄,并且補得很完善,幾乎可將評審的不符合項給推翻。等等。以上情況繼而可導致整改時間已過期。
答:①充分溝通,并在評審報告中說明。②查看實驗室的原因分析是否到位,要求實驗室制定糾正措施。③整改不允許補記錄、改記錄,應在今后的工作中改正。④如果由于實驗室的原因不能按期完成整改,評審組可建議暫停認可資格,如實上報。在末次會上應將此種情況明確告知實驗室。
76. 組長進行申請資料審核時,因專業限制,不能對所有專業的技術內容進行評審,如設備配置表、經歷報告、不確定度評估等,會給現場評審帶來一些問題。
答:評審組長可以向項目主管提出需求,由項目主管確定技術評審員后,由技術評審員進行審查。 CNAS實驗室認可

萊蕪實驗室資質認可
醫學實驗室認可
近20年來,我國臨床檢驗專業飛速發展,檢驗學科已經從醫學檢驗發展為檢驗醫學,對疾病的診斷、治療、及發病機理的探討等諸方面發揮著越來越重要的作用,醫院檢驗科的建設已成為衡量醫院水平的重要指標之一。縱觀我國醫療衛生單位的醫學實驗室,雖引進了大批先進的醫療設備、先進的實驗技術,每年有大批的檢驗技術人員出國進修學習、參加各種各樣的國際會議,同時也有不少的留學人員回國,加入到檢驗醫學的行列,但是我們和先進 的醫學實驗室仍然存在一定的差距,究其原因就是我們在醫學實驗室的管理上和國外存在一定的差距。國際標準化組織2003年正式發表了《醫學實驗室質量和能力的專用要求》,這個國際標準專門針對醫學實驗室的質量和能力的,并規范了其管理和技術要求。
2005年6月,中國實驗室 認可委員會(CNAL)發布消息,《醫學實驗室—質量和能力的專用要求》(15189)認可活動已被納入《國際實驗室認可合作組織相互承認協議》(ILAC-MRA)中,即CNAL依據15189認可的醫學實驗室,其簽發的檢驗報告可獲得與CNAL簽署多邊認可協議的 或地區的承認。我國是國際標準化組織的成員國,并且已經與世界上43個 和地區簽訂了互認協議,這就是說我國的臨床實驗室如果采用15189實施質量和能力的管理,并且能夠通過CNAL的認可,就表明的我們的醫學實驗室和國外的醫學實驗室在管理上處在同一水平,而且能被國際認可。下面就醫學實驗室認可在國內外的發展、認可的準則及醫學實驗室認可對我國檢驗醫學發展的重要意義做一探討。
一. 醫學實驗室認可的概念
CNAS-CL02對醫學實驗室(medical laboratory)或臨床實驗室(clinical laboratory)定義為:以診斷、、治療人體疾病或評估人體為目的,對取自人體的標本進行生物學、生物學、免疫學、化學、免疫血液學、血液學、生物物理學、細胞學、病理學或其它檢驗的實驗室,它可以對所有與實驗研究相關的方面提供咨詢服務,包括對檢驗結果的解釋和對進一步的檢驗提供建議。上述檢驗還包括對各種物質或生物進行判定、測量或描述存在與否的操作。哪些只是收集或制備標本的機構,以及標本郵寄或分發中心,盡管可能屬于某個更大的實驗室網絡或實驗室系統的一部分,也不能夠被當作醫學或臨床實驗室。根據這個定義我們認為,我國各級醫院(衛生機構)的檢驗科就是CNAS-CL02所說的醫學實驗室或臨床實驗室,所以,我國各級醫療機構的檢驗科就應該以15189為質量管理的標準。
認可(accreditation)是“由權威機構對某一機構或人員有能力完成特定任務作出正式承認的程序”。在《合格評定-對認可合格評定機構的認可機構的通用要求》中對認可給出了 的定義:“正式表明合格評定機構具備實施特定合格評定工作的能力的第三方證明”。也就是說獲得認可資格,即證明機構的質量體系運行有效和技術能力滿足要求,而且機構出具的測試結果是可靠的。在這里,權威機構是指中國 實驗室認可委員會,我們醫療單位的醫學實驗室也就是我們通常所說的醫院檢驗科,是申請認可的機構。
二. 醫學實驗室認可的發展歷史以及我國醫學實驗室認可的概況
1、 實驗室認可的發展: 1947年,澳大利亞成立了世界上 個 實驗室認可機構即澳大利亞 檢測機構協會(NATA)。自20世紀60年代,英國、美國、新西蘭、中國以及東南亞諸 相繼成立了 實驗室認可機構。亞太實驗室認可合作組織(APLAC)、歐洲實驗室認可合作組織(EAL,1998年改為EA) 也相繼成立,國際實驗室認可大會也完成了向國際實驗室認可合作組織(ILAC)的轉變,加之美洲認可合作組織(IAAC)和南部非洲認可發展合作組織(SADCA)的成立,形成了在ILAC下的四大實驗室認可區域組織。1999年12月,《檢測和校準實驗室能力的通用要求》作為《實驗室認可準則》,包括醫學實驗室在內的各行業的實驗室開始了實驗室的認可工作。2003年2月,又發布了《醫學實驗室質量和能力的專用要求》,成為醫學實驗室認可的專用準則。
2、 我國實驗室認可概況:1993年底,籌備中的原中國實驗室 認可委員會(CNACL)認可了 個實驗室,由此開始了我國的實驗室認可活動。我國作為APLAC的發起國之一參加了APLAC的 次會議,并于1995年4月作為16個成員之一首批簽署了APLAC的認可合作諒解備忘錄(MOU)。CNACL于1999年11月簽署了APLAC互認協議(MRA),2000年12月簽署了ILAC互認協議;中國出入境檢驗檢疫實驗室 認可委員會(CCIBLAC)于2001年通過APLAC同行評審,簽署了APLAC相互承認協議。為適應經濟全球化和中國加入世界貿易組織(WTO)的新形勢,滿足我國對WTO的有關承諾,在2002年7月4日,我國政府將原CNACL和原CCIBLAC合并,成立新的中國實驗室 認可委員會(CNAL),實現了我國統一的實驗室認可體系。截止到2005年6月,CNAL已經認可了各行各業的境內、外2038家實驗室,已與國際上30來個經濟體的近50個認可機構簽署了互認協議,這意味著,CNAL的認可可以得到這些經濟體認可機構的承認。CNAL從2004年7月1日起開始受理依據15189的認可申請,解放軍總醫院(301醫院)臨床檢驗科經過3年多的積極準備,2005年6月通過了由CNAL組織的專家現場評審,成為我國 家依據15189為準則申請認可的醫學實驗室。
三. 醫學實驗室認可的準則
1、 CNAL的實驗室認可準則:CNAL的認可活動嚴格依據其認可準則進行。CNAL根據國際要求將《檢測和校準實驗室能力的通用要求》作為《實驗室認可準則》,是適用于所有類型實驗室的通用要求。2003年2月,國際標準化組織又發布了《醫學實驗室質量和能力的專用要求》。在15189沒有正式發布前,CNAL就已經使用17025認可了一些醫學領域的實驗室,目前,CNAL已決定將這兩個標準作為對醫學實驗室認可的準則,醫學類實驗室可根據其自身工作特點及管理部門和用戶的要求,選擇使用。15189從管理要求和技術要求兩大方面提出了醫學實驗室應遵守的要求。在管理方面,描述了實驗室組織和管理以及質量管理體系、服務活動要素等方面的要求;在技術要素上,則對人員、設備、設施等要素以及檢驗程序和結果報告等要點做出了規定。有一點我們可以肯定,15189 是指導醫學實驗室建立完善和先進質量管理體系的當前 、適用的標準。正像該標準起草委員會的約翰先生所說:“這個標準將指導醫學實驗室更為有效地開展工作,并能夠幫助實驗室更好地滿足客戶的要求,改進對患者的服務”。
2、 15189與17025的關系:15189與17025標準的關系是: 17025作為實驗室能力的通用要求,適用于所有類型和規模的實驗室,這在該標準的“范圍”中有清晰的描述。該標準以管理要求和技術要求兩大主體部分,24個要素的形式規范了實驗室檢測和校準活動的關鍵要素。只要實驗室(包含醫學實驗室)嚴格遵守這些要求,便能夠規范地開展工作。15189則從醫學專業的角度,使用了醫學專業術語細化地描述了醫學實驗室質量管理的要求,專用性更強,更方便醫學實驗室使用。15189的附錄改變為對實驗室息系統(LIS) 的要求和提供了實驗醫學中倫理學的有關內容等。
綜上所述,通過開展有效的質量管理活動,不斷提高自身能力建設和服務意識,從而增強醫學實驗室的綜合競爭力,是市場的要求,更是實驗室自身發展的要求,而認可,是緊跟國際發展趨勢、應用了當前先進的國際標準、指南等,并考慮了我國國情的先進的事物,因此可以說,尋求實驗室認可,是促進和提高醫學實驗室質量。
四. 醫學實驗室認可的意義
通過醫學實驗室的認可,可以提高醫學實驗室的質量管理水平,減少可能出現的質量風險和實驗室的責任,平衡實驗室與患者之間的利益,提高社會對認可實驗室的任度。15189其實質是醫學實驗室檢驗/校準質量風險的控制要求。嚴格持久地按照要求去做,實驗室的檢驗/校準質量就得到了保證,從而貴單位形象,擴大檢驗份額,提高實驗室的依賴度。
通過醫學實驗室的認可,可以不斷提高醫學實驗室的譽,增強患者及醫務人員對實驗室的任。醫療單位通過了9000質量體系評審,這僅是證明醫療過程得到了保證,而并不證明終檢驗結果的合格。而經過15189認可的醫學實驗室通過其完善的管理,能夠向患者以及醫護人員提供準確的檢驗結果。
通過醫學實驗的認可,可以國際交流中的技術壁壘,互認檢測結果。我國認可的實驗室出具的檢驗/校準數據能夠得到國際社會的承認,表明實驗室具備了按國際認可準則開展檢測的技術能力,在認可范圍內使用“中國實驗室 認可”標志列入《 認可實驗室目錄》,提高知名度。促進國內醫學實驗室與國際接軌,促進國際間的交流。
五. 如何進行醫學實驗室的認可工作
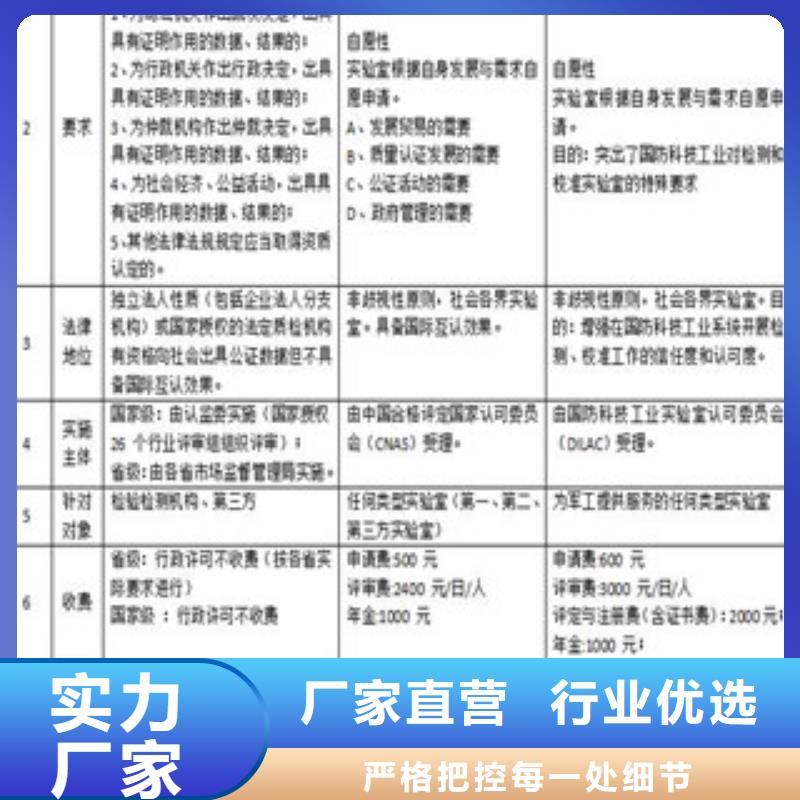
1、 實驗室調查研究階段。實驗室相關工作人員查閱資料,了解背景,理解認可帶來的意義和好處,以及認可所需的投入包括資金、人力和物力。經過充分醞釀和討論,實驗室管理層研究決定申請認可,加入 實驗室認可體系。這一階段不是可以缺少的,只有經過了解背景知識,機構管理層的研究討論,形成決議后,才能在申請認可過程中,克服各種困難,集合機構所有的資源,特別是人力資源,才能真正作到通過實驗室認可這個途徑,提高實驗室的管理水平和技術能力。
2、 質量體系建立階段,在這個階段,實驗室初步建立質量體系。在此階段,實驗室管理層指定技術負責人、質量負責人和聯系人,組織相關人員培訓,包括派人員出去學習或者請認可專家來本機構進行講課,在技術能力建設上,購買儀器和設備,進行量值溯源。將實驗室運行狀況文字化,形成文件,制訂質量手冊和程序文件。對有些方法、儀器設備使用編寫作業指導書,形成下一層次的文件。這樣,初步建立了質量體系。體系建立后,試運行,進行一次內部評審,將內審結果作為輸出,進行一次全要素的管理評審,以評價質量體系的有效性。對內審和管理評審的結果,按照PDCA的工作思路,即P(Plan)計劃、D(Do)執行、(Check)檢查和A(Action)實施改進,以便對質量體系不斷完善和持續改進。這段時間一般長于6個月。
3、 填寫申請書階段。按照認可機構的相關要求,填寫申請書和附表,描述實驗室的檢測、校準能力,以及提供證明其能力的依據。這項工作復雜,大約需要1個月時間完成。這段時間是實驗室管理層學習15189 ,真正理解和掌握標準的機會。以質量手冊為依據,將實際工作過程形成文件,制訂程序(Plan) ;運行程序(Do) ,發現實際狀況與程序不符合(Check) ,不符合項越多,進步越快,理會越深入;采取糾正措施,解決不合適的地方(Action),進行跟蹤審核等。如此反復,實驗室把注意力投入體系和技術能力建設,才發現6個月時間太短了,要學習的東西太多了。只有如此,實驗室才能了解到標準的精髓,真正掌握標準,才能將標準為我所用,提高實驗室的管理水平和技術能力,做到與國際接軌。
4、 現場評審階段。中國合格評定 認可委員會根據申請方的實際情況組織安排評審組并確定評審時間,對申請方進行、系統、細致的審核。
5、 評審后整改階段。對評審后不符合之處做以詳細的修改補充,并上報評審組。
六. 咨詢機構輔助醫學實驗室進行認可工作的意義
1、 編制全程工作計劃,以免實驗室無計劃進行認可工作;
2、 策劃專題培訓并到實驗室進行現場培訓,減少實驗室外出培訓的開支;
3、 咨詢專家會同實驗室內部人員進行文件策劃及文件編寫工作,提供電子文件范本,減少實驗室內部人員編寫文件的繁重工作量;
4、 在文件運行過程中,咨詢專家到實驗室進行運行指導(包括表單記錄的填寫、硬件設施的配置及改造、實間質評、設備校準、設備檔案管理、樣品標識、物品試劑管理、實驗室管理等),對癥下藥,使實驗室少走彎路,節省獲取醫學實驗室 認可的時間;
5、 指導填寫《醫學實驗室 認可申請書》,協助實驗室遞交相關資料給中國合格評定 認可委員會;
6、 協調和處理與中國合格評定 認可委員會往來的文件和資料,使實驗室少走彎路;
7、 確保實驗室一次性成功通過中國合格評定 認可委員會所派專家組的現場評審,避免重復評審,節約相關開支;
8、 協助整改中國合格評定 認可委員會所派專家組提出的不符合項,協調與中國合格評定 認可委員會的關系,幫助實驗室盡早獲取認可;
9、 實驗室可吸收咨詢專家輔導不同單位的經驗,博采眾長,取長補短。
CMA計量認證 CNAS實驗室認可 咨詢指導!



海納德管理咨詢有限公司價值觀:創新、品質、誠信、合作共贏
使命:讓地面更美好,讓生活更幸福
理念:用更有價值的 山東萊蕪實驗室資質認可產品與理念讓更多人真正受益
愿景:致力于打造一家受人尊敬的,更具社會影響力的 山東萊蕪實驗室資質認可企業